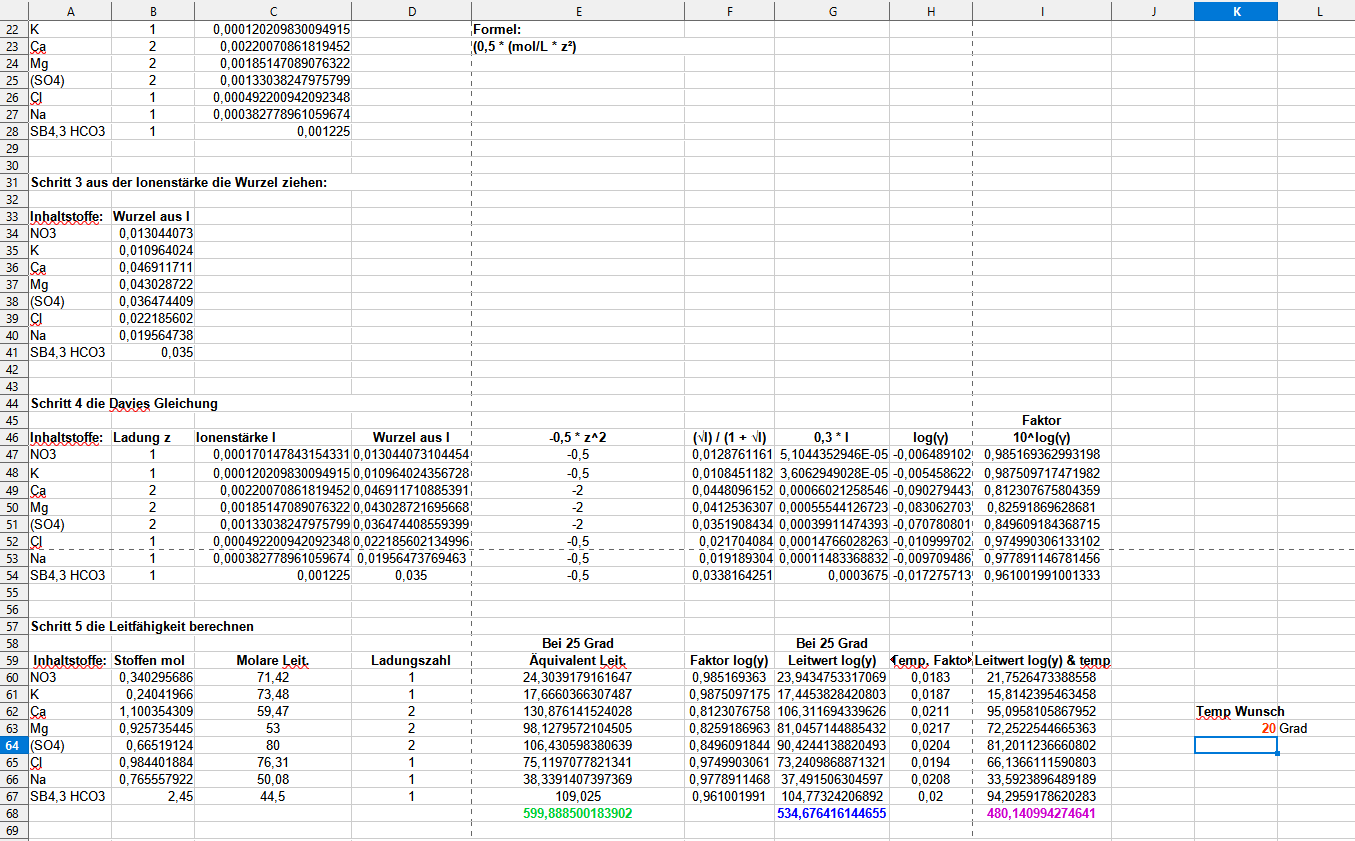
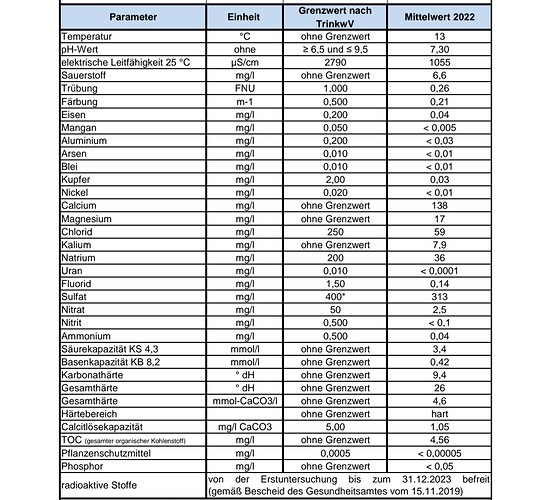
Hallo, ich melde mich mal wieder mit einem kleinem Update…
das freut mich und ja, sie kommt so langsam aber sicher ![]()
Nun, wir haben durch die hohen pH-Werte die am Anfang geherrscht haben wohl einen Zinkmangel reinbekommen, den wir auch mal mit der KI mehr schlecht als recht ermittelt haben.
Defomierte aber auch unvollständig ausgebildete Blätter und andere ausgetrocknete Blattstellen deuten eben darauf hin, aber schaut selbst! ![]()
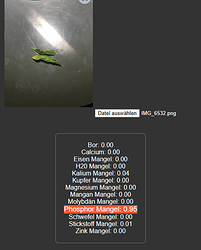
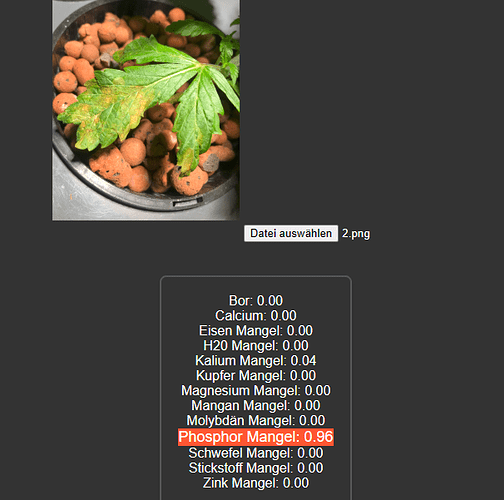
Einmal unbearbeitet mit normalem Foto ist es ein Phosphormangel:
Einmal mit Paint bearbeitet ist es ein Phosphor und Zinkmangel:
Und ja ich weis, Zink soll durch hohe Phosphorwerte ausgebremst werden, aber eben auch durch zu hohe pH-Werte, daher ist es wohl eher auf den pH-Wert zurück zuführen und der Vernächlässigung der RFL die bei mir eben immer konstant 30% ist. ![]()
Nunja, aber aktuell läuft es eigentlich ganz gut wie ihr nun sehen könnt…
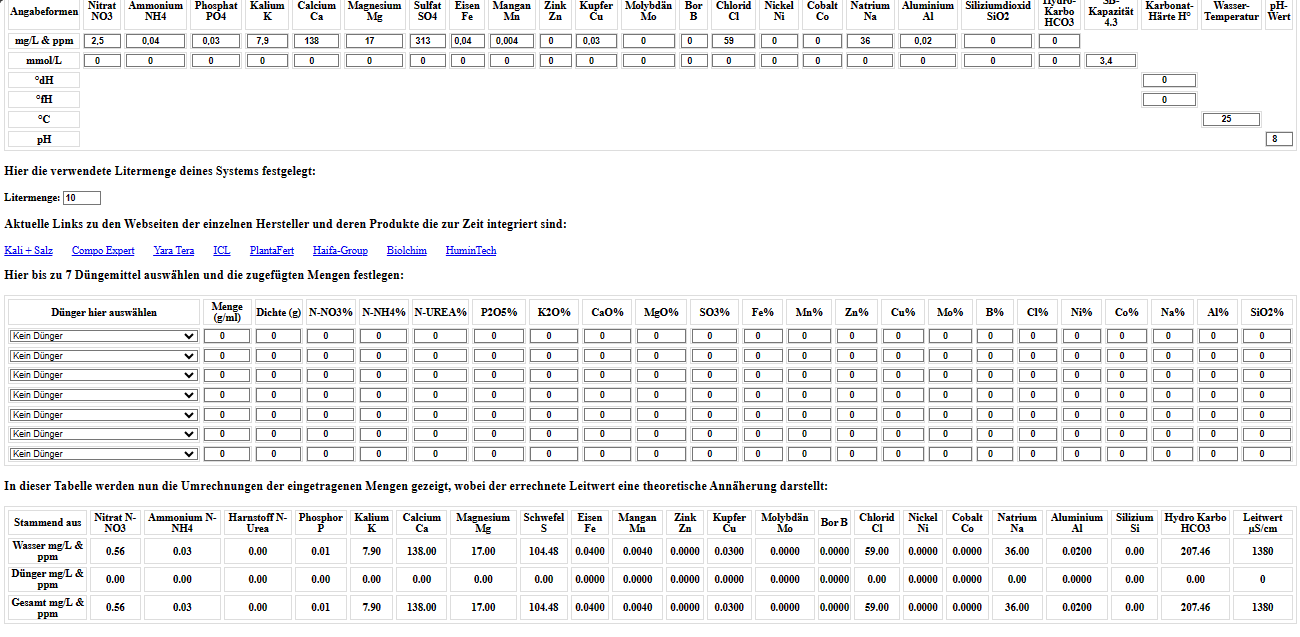
Ich hatte nochmal 0,2g Ferty AS zugeführt, um zu sehen ob sie schneller den pH Wert auf ein gutes Level bringt, aber das war wohl wieder mal etwas zuviel…
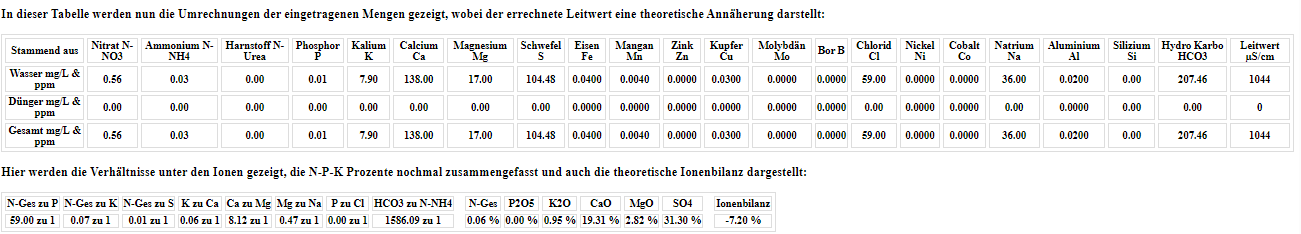
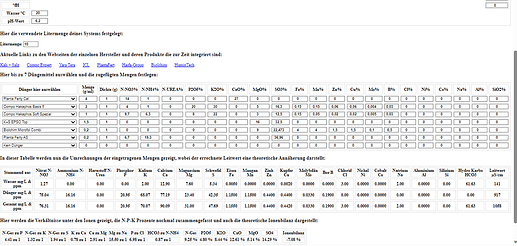
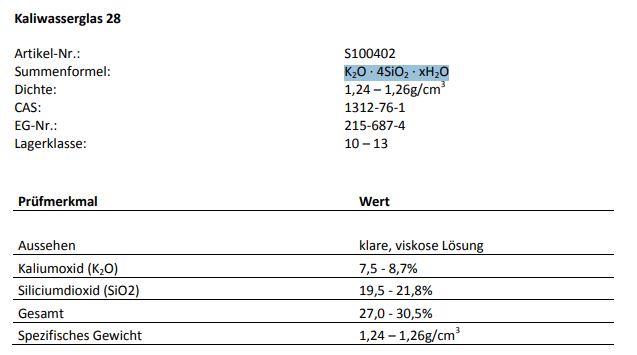
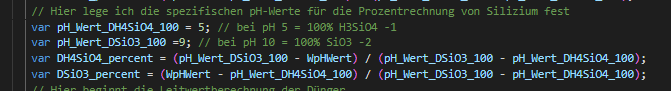
Sie arbeitet jetzt so wunderbar den pH-Wert runter, das ich jetzt wieder schrittweise 0,5ml Kaliwasserglas 28BE zugeführt habe, da der pH-Wert schon an die 5,6 pH ging und bin jetzt wieder relativ stabil bei 6.
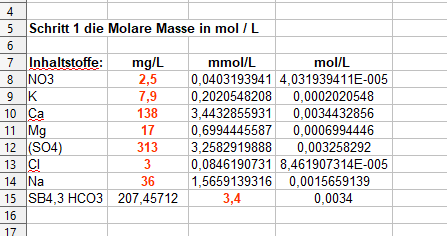
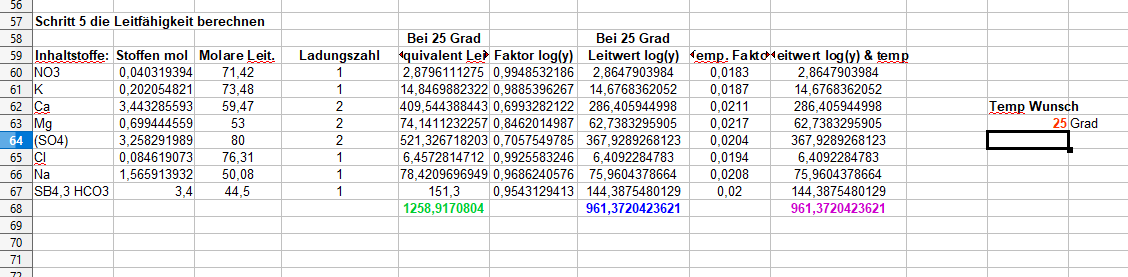
Der Leitwert beträgt 1,08 und der Wasserverbrauch nimmt jetzt auch endlich mal stetig zu…
Tja, also dann… mehr gibt es erstmal nicht zu berichten.
Ich wünsche euch einen guten Wochenstart mit all den kommenden Streiks und hoffe ihr erreicht eure Ziele ab Morgen dennoch.
Bis Sonntag dann wieder, euer Kushi ![]()
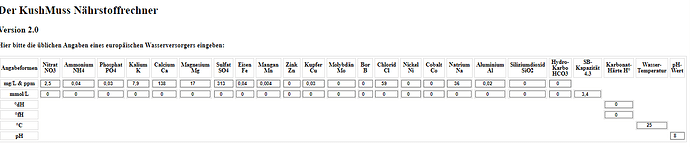
(p.s. die Schleichwerbung ist auch noch am Start… denn falls ihr die Vertrauens-Stufe in unserem Forum habt, schaut doch mal in die Grower Lounge rein, denn dort gibt es jetzt auch die 2.0 Version von meinem Nährstoffrechner zum downloaden)